文章內容
物質的鍵結(Chemical bonding)
請自行調高解析度
❒ 離子鍵(Ion bond)
科學家發現,不同的原子核對周圍電子的吸引力不同,我們稱為「電負度」,電負度不同造成陰離子與陽離子:知識力www.ansforce.com。
➤陰離子:電負度大則原子核容易吸引電子而帶負電,形成「陰離子」,例如:氯離子(Cl-)。
➤陽離子:電負度小則原子核容易釋放電子而帶正電,形成「陽離子」,例如:鈉離子(Na+)、鉀離子(K+)。知識力www.ansforce.com。
物質的原子與原子之間因為陰離子與陽離子「正負相吸」而形成的鍵結稱為「離子鍵(Ion bond)」,如<圖一>所示,例如:氯化鈉(NaCl)、氯化鉀(KCl)等都是屬於離子鍵。
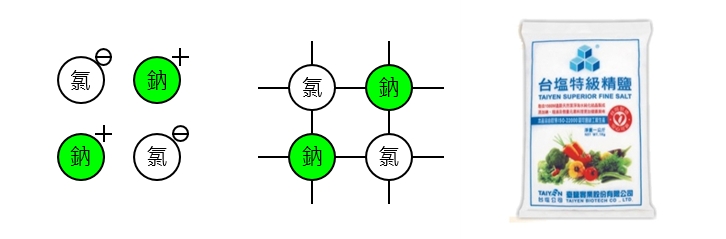
圖一 物質的離子鍵(Ion bond)示意圖。
離子鍵是所有的化學鍵結裏強度最大的,所以要將氯離子與鈉離子分開很困難,當我們對固體加熱則固體原子開始振動,最後鍵結斷裂形成液體,我們稱為「熔化」,如果我們對氯化鈉加熱要使氯化鈉熔化必須加熱到800C以上,顯然要使氯化鈉的離子鍵斷裂並不容易。氯化鈉俗稱「食鹽」,就是我們在廚房裏用的那個鹹鹹的東東啦!有人會問:不會呀~要讓氯化鈉「溶化」好像只要將氯化鈉丟到水裏就好了呀!怎麼會困難呢?請注意「熔化(Melt)」和「溶化(Dissolve)」的意義不同,「熔化」是指直接加熱使固體變成液體;「溶化」是將固體溶解在液體中,離子鍵的另外一個特色是很容易溶化(溶解在水中)。
【生活常識】食鹽與低鈉鹽
我們日常所吃的食鹽就是氯化鈉(NaCl),台灣早年因為比較窮苦,大家吃的比較差,所以身體缺乏鈉離子,可是現在大家都吃的很好了,所以並不缺乏鈉離子,反而開始缺乏鉀離子,於是開始有人推廣食用「低鈉鹽」,所謂的低鈉鹽其實就是用部分的氯化鉀(KCl)取代氯化鈉,大家可以拿起廚房裡用的低鈉鹽,就可以看到成份為氯化鈉(NaCl)含量大約60%、氯化鉀(KCl)含量大約40%。
❒ 共價鍵(Covalent bond)
物質的原子與原子之間因為共用「鍵結電子」而形成的鍵結稱為「共價鍵(Covalent bond)」,例如:無機化合物的碳(C)、矽(Si)、砷化鎵(GaAs),以及所有的有機化合物都是屬於共價鍵。我們以碳為例說明共價鍵如何形成:碳屬於4A族元素,原子核外有4個鍵結電子,利用這些鍵結電子可以形成共價鍵,如<圖二>所示。知識力www.ansforce.com。
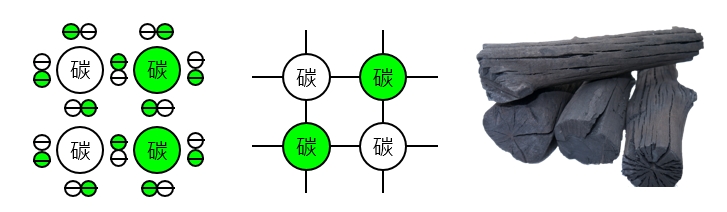
圖二 物質的共價鍵(Covalent bond)示意圖。
資料來源:www.lyg.com.tw。
❒ 金屬鍵(Metal bond)
在所有的化學鍵裡,金屬鍵是最奇怪的一種,由於金屬原子導電性極佳,代表電子可以在金屬中自由移動,可是帶負電的電子明明又是被帶正電的原子核吸引住才對,怎麼可能會自由移動呢?這個問題困擾科學家很久,到現在還沒有答案,比較被大家接受的一種說法是,金屬物質的電子是「自由分布」在空間中,我們稱為「電子海」,原子核再分散在電子海裡,如<圖三>所示。例如:無機化合物的金(Au)、銀(Ag)、銅(Cu)等都是屬於金屬鍵。
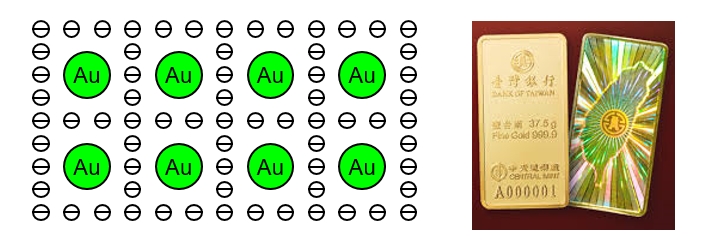
圖三 物質的金屬鍵(Metal bond)示意圖。
資料來源:www.bot.com.tw。
❒ 氫鍵(Hydrogen bond)
科學家發現,氟(F)、氧(O)、氮(N)的電負度比氫(H)大,所以在氟、氧、氮與氫的化合物中,氟、氧、氮原子會微微帶負電,氫原子會微微帶正電,但是整個分子還是電中性的,如<圖四(a)>所示。
含有氫氟鍵(HF)、氫氧鍵(HO)、氫氮鍵(HN)的化合物之間,因為氟、氧、氮原子與氫原子之間「正負相吸」而形成的吸引力稱為「氫鍵(Hydrogen bond)」,值得注意的是,氫鍵其實是分子與分子之間的吸引力,並不算真正的鍵結,例如:無機化合物的氫氟酸(HF)、水(H2O)、氨(NH3),有機化合物的氨基酸與蛋白質、核苷酸與核酸(DNA、RNA)等的分子與分子之間都會產生氫鍵。
我們以氫氟酸(HF)、水(H2O)、氨(NH3)為例說明氫鍵如何形成:氫氟酸(HF)的氟帶負電、氫帶正電,所以不同的氫氟酸分子會互相吸引形成氫鍵,如<圖四(b)>所示;水(H2O)的氧帶負電、氫帶正電,所以不同的水分子會互相吸引形成氫鍵,如<圖四(c)>所示;氨(NH3)的氮帶負電、氫帶正電,所以不同的氨分子會互相吸引形成氫鍵,如<圖四(d)>所示。知識力www.ansforce.com。
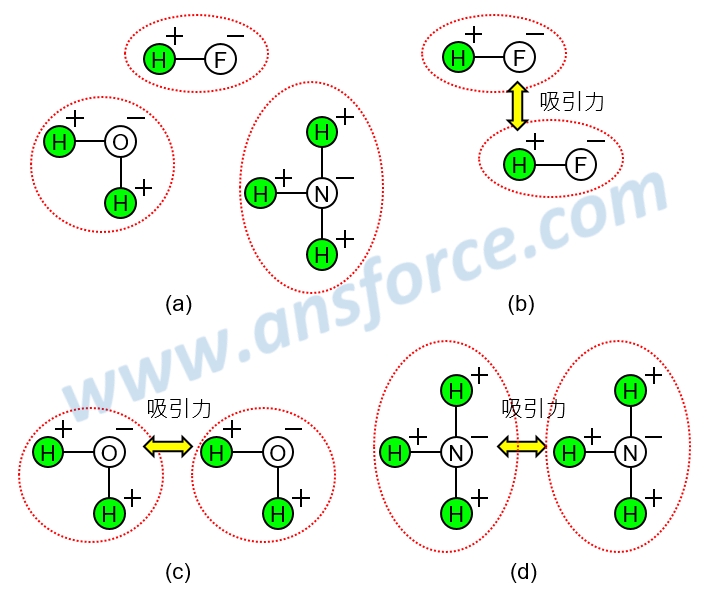
圖四 物質的氫鍵(Hydrogen bond)示意圖。
【生活常識】水與冰
大家都知道物質具有熱脹冷縮的現象,所以鐵軌與鐵軌之間必須保留空隙才能避免在太陽的高溫照射下變形,可是水卻是一種奇怪的物質,當我們將水的溫度降低變成冰,體積不但沒有變小反而變大,大家都有這樣的經驗,夏天到了我們用保特瓶裝水放到冰箱的冷凍庫裡,結果水變成冰將保特瓶脹開,顯然是體積變大了,科學家們發現,就是因為水分子之間具有氫鍵,形成冰的時候會將分子與分子撐開形成結晶結構,所以體積變大了。知識力www.ansforce.com。
O 物質的鍵結強度
➤熔點(Melting point):物質由固態轉變為液態時的溫度,由於物質由固態變成液態時,物質吸收了熱能使得原子開始振動,造成固體原子與原子的距離變大而形成液體。
➤沸點(Boiling point):物質由液態轉變為氣態時的溫度,由液態變成氣態時,物質吸收了熱能使得原子振動得很厲害,造成液體原子與原子的距離更大而形成氣體。
物質的鍵結強度大小依序為:離子鍵>共價鍵>金屬鍵>氫鍵,鍵結強度愈大,代表原子與原子的距離變大愈困難,因此一般而言,熔點與沸點愈高。
【請注意】上述內容經過適當簡化以適合大眾閱讀,與產業現狀可能會有差異,若您是這個領域的專家想要提供意見,請自行聯絡作者;若有產業與技術問題請參與社群討論。
【延伸閱讀】其他詳細內容請參考「積體電路與微機電產業,全華圖書公司」。<我要買書>
